Nung a gam thuốc tím (chứa 20% tạp chất trơ) đến khi có 8,4 lít khí oxi (đktc) thoát ra thì ngừng nung, biết hiệu suất của phản ứng đạt 80%. Tính a?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đầu tiên phải đổi về số mol đã:
PTHH: 2 KMnO4
K2MnO4 + MnO2 + O2
pt 2 1 1 1
Mol 0,9 0,45 0,45 0,45
Hp/ứ = 80% m KMnO4 ban đầu =
nKMnO4 ban đầu = 177,75: 158 = 1,125 mol
nKMnO4 dư= 1,125 – 0,9 = 0,225 mol.
Thuốc tím có lẫn 10% tạp chất
m thuốc tím =
Khối lượng chất rắn sau phản ứng: 197,5 – 0,45.32 = 183,1 gam
Chất rắn sau phản ứng gồm KMnO4 dư, K2MnO4, MnO2, tạp chất.
%MnO2/CR=
%K2MnO4/CR=
\(n_K=n_{O_2}=\dfrac{V}{22,4}=0,45\left(mol\right)\)
\(PTHH:2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\)
....................0,9..............................................0,45........
\(\Rightarrow m_{KMnO_4}=n.M=142,2\left(g\right)\)
Mà H = 80 %
\(\Rightarrow m_{KMnO_4tg}=177,75\%\)
Lại có : Trong m g thuốc tím chỉ có 90% phản ứng .
\(\Rightarrow m=197,5\left(g\right)\)
Vậy ...

a. \(2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\)
\(n_{KMnO_4}=0,6mol\)
\(\rightarrow n_{O_2}=\frac{1}{2}n_{KMnO_4}=0,3mol\)
\(\rightarrow V_{O_2}=6,72l\)
\(V_{O_2\text{thực}}=\frac{6,72.75}{100}=5,04l\)
b. \(2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\)
\(n_{O_2}=1,5mol\)
\(\rightarrow n_{KMnO_4}=2n_{O_2}=3mol\)
\(\rightarrow m_{KMnO_4\text{cần}}=\frac{474.100}{80}=592,5g\)

`a)`
`n_{CO_2} = (100,8)/(22,4) = 4,5(mol)`
$PTHH: CaCO_3 \xrightarrow{t^o} CaO + CO_2$
Theo PT: `n_{CaCO_3} = n_{CO_2} = 4,5(mol)`
`=> m_{CaCO_3} = 4,5.100 = 450(g)`
`=> m=m_{đá.vôi} = (450)/(90\%) = 500(g)`
`b)`
`n_{CaCO_3(ban.đầu)} = (4,5)/(80\%) = 5,625(mol)`
`=> m_{CaCO_3} = 5,625.100 = 562,5(g)`
`=> m=m_{đá.vôi} = (562,5)/(90\%) = 625(g)`
`c)`
`M_{Khí} = 14,75.2 = 29,5(g/mol)`
Áp dụng sơ đồ đường chéo, ta có:
`(V_{O_2})/(V_{N_2}) = (29,5-28)/(32-29,5) = 3/5`
Vậy trộn `N_2,O_2` the tỉ lệ thể tích `V_{O_2} : V_{N_2} = 3:5` thì thu được hỗn hợp khí có tỉ khối với `H_2` là `14,75`

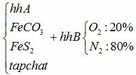
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
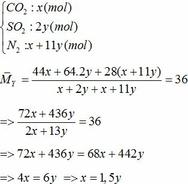
Khối lượng Fe có trong Z là:
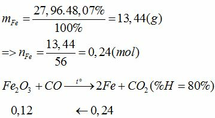
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
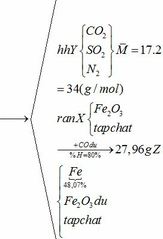
b) hỗn hợp Y gồm:
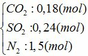
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
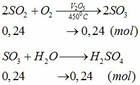
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
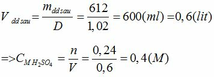

\(m_{KMnO_4}=31,6.98\%=30,968g\)
\(m_{KMnO_4}=30,968.95\%=29,4196g\)
\(n_{KMnO_4}=\dfrac{m_{KMnO_4}}{M_{KMnO_4}}=\dfrac{29,4196}{158}=0,1862mol\)
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,1862 0,0931 ( mol )
\(V_{O_2}=n_{O_2}.22,4=0,0931.22,4=2,08544l\)
\(n_{KMnO_4}=\dfrac{31,6.98\%}{158}=0,196\left(mol\right)\\ 2KMnO_4-^{t^o}\rightarrow K_2MnO_4+MnO_2+O_2\\ n_{O_2\left(lt\right)}=\dfrac{1}{2}n_{KMnO_4}=0,098\left(mol\right)\\ Vìhaohụt5\%\\ \Rightarrow V_{O_2\left(tt\right)}=0,098.95\%.22,4=2,08544\left(l\right)\)

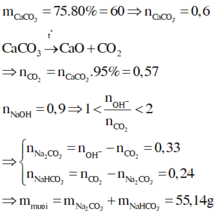
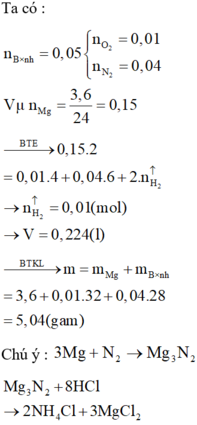

Ta có: \(n_{O_2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\)
PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Theo PT: \(n_{KMnO_4\left(LT\right)}=2n_{O_2}=0,75\left(mol\right)\)
Mà: H = 80% \(\Rightarrow n_{KMnO_4\left(TT\right)}=\dfrac{0,75}{80\%}=0,9375\left(mol\right)\)
\(\Rightarrow m_{KMnO_4\left(TT\right)}=0,9375.158=148,125\left(g\right)\)
Mà: Thuốc tím chứa 20% tạp chất trơ.
\(\Rightarrow a=\dfrac{148,125}{80\%}=185,15625\left(g\right)\)